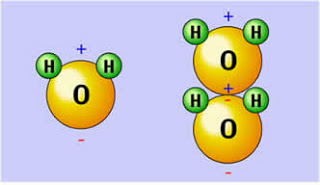
A polaridade das moléculas é um fenômeno baseado na separação de cargas elétricas.
Em química, chamamos de polaridade das moléculas a separação das cargas elétricas, que fazem com que essas moléculas formem dipolos elétricos. Nesse processo, as moléculas polares interagem por meio da força intermolecular ou das ligações de hidrogênio.
A polaridade molecular depende de algumas condições, como: a diferença de eletronegatividade entre os átomos e a geometria molecular.
Um exemplo clássico de moléculas polares é a molécula de açúcar, ou sacarose. Esses compostos apresentam muitos grupos de oxigênio-hidrogênio (-OH) e por isso são muito polares.
As moléculas polares têm ponto de ebulição mais alto em razão da grande interação dipolo-dipolo entre as moléculas. Um outro exemplo é a molécula da água, que por ser bastante polar, é capaz de dissolver substâncias polares.
Nesse contexto, também temos os compostos apolares, que são as gorduras, os óleos e a gasolina. Esses compostos são insolúveis em água. Assim, podemos definir que:
Na Molécula apolar – a soma dos vetores polarização e de todas as ligações covalentes polares da molécula é nula.
Na Molécula polar – a soma vetorial dos vetores polarização e de todas as ligações covalentes polares na molécula é diferente de zero.
Deixe um comentário